Autoimmunità e alimentazione

Il problema dell’autoimmunità
Il sistema immunitario ha tra le sue funzioni quella di proteggere il corpo da agenti esterni quali virus o batteri attraverso la produzione di anticorpi (immunità acquisita) o di specifiche classi di leucociti (immunità innata). Normalmente questa struttura difensiva attacca gli antigeni estranei ma non le cellule del proprio corpo. In taluni casi però, il sistema va in confusione e attacca erroneamente le cellule che dovrebbe difendere, il proprio “self”, dando luogo a tutte le patologie definite autoimmuni. Esistono un centinaio di patologie autoimmuni dalle più comuni a quelle più rare ed hanno caratteristiche e tessuti bersaglio diversi.
Alcune tra le più note malattie autoimmuni
Questa lunga lista comprende patologie rare e meno rare. Tra quest’ultime rientrano tra le altre: l’alopecia areata, il lupus eritematoso, l’artrite reumatoide, il morbo celiaco, le tiroiditi autoimmuni, il morbo di Crohn, la rettocolite ulcerosa, la psoriasi, la sclerosi multipla e il diabete mellito di tipo 1 (DMT1).
Incremento dei casi e genetica
La prevalenza di malattie autoimmuni sta registrando una decisa crescita nei paesi maggiormente sviluppati dal dopo guerra ad oggi e, negli U.S.A., si stima che 1 persona su 13 ne sia affetta. Per alcune di queste, come il DMT1 e la celiachia, è nota una loro componente genetica, ma la crescita dei casi nel giro di una o due generazioni non può essere spiegato solo da determinanti geniche; a supporto di ciò, e sull’importanza della componente ambientale nel contesto dell’autoimmunità, sono gli studi di genetica su gemelli omozigoti che mostrano come solo in meno del 50% dei casi entrambi i fratelli sviluppano la malattia (1).
Ruolo dei fattori ambientali
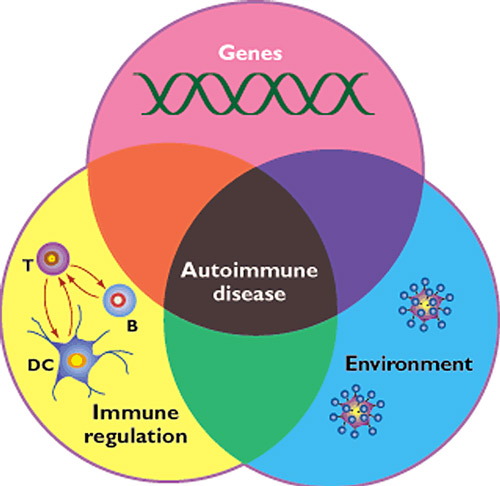
Figura 1: Convergenza delle componenti genetiche, ambientali e di disregolazione immunitaria nella generazione di patologie autoimmuni (1).
I fattori ambientali sono rappresentati da elementi esterni cosiddetti “non self”. Per fare un esempio di fattore esterno, si può citare la celiachia in cui il glutine, contenuto nei cereali e derivati, rappresenta l’elemento esterno che scatena la reazione difensiva rivolta contro componenti tissutali dell’intestino tenue. In altri casi, come nella neuropatia Guillain Barré, il fattore ambientale scatenante un’aberrante risposta immunitaria è rappresentato da un agente infettivo come ad esempio il Campylobacter jejuni, l’Epstein Barr virus, o il virus dell’influenza per citarne alcuni.
Diversi studi hanno, inoltre, individuato altri fattori ambientali coinvolti nei meccanismi dell’autoimmunità nei numerosi additivi che sono presenti nei cibi processati (2), altri ancora nei residui chimici incluso il diffusissimo erbicida glifosate.
Ipotesi igiene
L’ipotesi igiene nasce dall’osservazione che nei paesi più industrializzati vi sia stato, negli ultimi 40 anni, un decremento di infezioni ed un parallelo incremento delle malattie autoimmuni e dei fenomeni allergici. Una maggiore igiene determina il mancato contatto dell’organismo con una varietà di microrganismi – patogeni e non – che stimolano il sistema immunitario come i linfociti T regolatori e i Toll-like-receptor. Questa ipotesi, nata alla fine degli anni ‘80 (4), si è nel tempo ampliata includendo altri fattori predisponenti legati allo stile di vita che accompagnano lo sviluppo economico, come ad esempio le modifiche nell’alimentazione. E sono proprio i cambiamenti alimentari che impattano notevolmente sull’intestino e il microbioma.
Il meccanismo legato ai fenomeni immunitari intestinali ha inizio con l’attivazione delle cellule dendritiche da parte dell’antigene e termina con la produzione linfociti T regolatori che aiuteranno a contrastare futuri contatti con l’agente esterno. Nelle allergie e nelle autoimmunità si determina una eccessiva risposta verso l’antigene. Il meccanismo di regolazione indotto da parassiti intestinali parte dal legame antigene-anticorpo (IgG o IgE) che innesca altri elementi dell’immunità. Questi, come le cellule dendritiche, producono mediatori (interleuchine) che vanno a stimolare la produzione di linfociti di classe Th2 e T reg che regolano la risposta immunitaria agli antigeni, evitando fenomeni di ipersensibilità.
Ruolo emergente dell’intestino e del microbiota
L’epitelio intestinale insieme allo strato di muco e alle colonie di microrganismi (microbiota intestinale) rappresentano la barriera che effettivamente separa l’organismo dall’ambiente esterno rappresentato da ciò che entra attraverso il tubo digerente. Sapendo che oltre il 70% del nostro sistema immunitario risiede nell’intestino, risulta evidente che lo stato in cui si trova quest’organo – incluso il sistema funzionale rappresentato del microbiota che vi alberga – riveste un ruolo importante nella regolazione immunitaria.
In particolare, è emerso il ruolo chiave delle giunzioni serrate tra le cellule dell’intestino che – insieme al sistema immunitario mucosale – garantiscono l’integrità della barriera del tenue che non deve mostrare fenomeni anomali di permeabilità detti “leaky gut”. Un intestino in condizioni di alterata permeabilità non funge da barriera selettiva all’ingresso indesiderato di antigeni, tossine o batteri che passano nei tessuti sottostanti e nel torrente ematico dando origine a fenomeni infiammatori.
Altro elemento di fondamentale importanza è un microbiota in equilibrio che presenti colonie di batteri, virus e miceti in condizione di equilibrio (eubiosi) e protettivi da specie patogene e da infiammazione. L’intestino permeabile e la disbiosi* sono un elemento emergente nel quadro dei fenomeni di autoimmunità.
* Disbiosi: termine che descrive un cambiamento quali-quantitativo delle specie microbiche intestinali che altera il normale equilibrio e la formazione dei prodotti della fermentazione. La disbiosi è spesso associata a fenomeni infiammatori e a problematiche intestinali.
La dieta nell’autoimmunità
Attualmente nel mondo scientifico manca un consenso su quale possa essere il ruolo della dieta nelle malattie autoimmuni e generalmente non vengono fornite ai pazienti indicazioni sull’alimentazione da seguire. Vi sono alcune impostazioni dietetiche (principalmente di matrice statunitense) basate su esclusioni di gruppi alimentari, come ad esempio alcuni tipi di cereali o di latte e derivati, che andrebbero approfondite; hanno mostrato risultati positivi in studi preliminari, ma anche criticità nel bilanciamento dei nutrienti o nell’impoverimento della diversità microbica intestinale, generando altre tipologie di problematiche.
Il cibo resta comunque un fattore ambientale su cui vale la pena intervenire comunque, anche in mancanza di evidenze che, in campo nutrizionale, è sempre complicato ottenere. Può essere utile, ad esempio, seguire un’alimentazione che preservi l’integrità intestinale, la biodiversità del microbiota e la modulazione immunitaria.
Tra i micronutrienti protettivi della permeabilità intestinale tra le più studiate rientra la vitamina D che induce l’espressione genica di proteine quali la zonulina e l’occludina che sono responsabili del mantenimento delle giunzioni enterocitarie serrate.
Altro elemento nutrizionale importantissimo per la salute dell’intestino sono le fibre. Una dieta povera di fibre manca di substrato per i microrganismi che la fermentano formando acidi grassi a catena corta (SCFA) ad azione protettiva e che inducono la formazione di muco protettivo tipico di un intestino sano. L’alimentazione moderna si è impoverita sia nella quantità di fibre (17 g/die contro i 30 g/die previsti dai LARN) sia nella varietà (poche specie di piante edibili contro le centinaia delle popolazioni più arcaiche).
Per quanto riguarda i grassi, si è visto che quelli saturi a lunga catena hanno un’azione su alcune tipologie batteriche (es. Oscillibacter) che impoveriscono di muco il colon o ancora che inducono uno squilibrio nelle classi di linfociti T, incrementando la proliferazione dei Th1 e dei Th17 implicati nei fenomeni autoimmuni e nella generazione di citochine pro-infiammatorie.
Attività esattamente contrarie sono state osservate con gli SCFA (prodotti dalla fermentazione delle fibre) che hanno mostrato un effetto stimolatorio sull’espressione dei linfociti T regolatori ad effetto positivo su fenomeni autoimmunitari e antinfiammatori.
Vale la pena citare anche i grassi Omega-3, in particolare EPA e DHA, per la loro azione immunomodulante diretta ed antinfiammatoria attraverso metaboliti bioattivi quali resolvine, protectine e maresine e il bilanciamento delle vie metaboliche pro-infiammatorie. Oltre ai più studiati impieghi degli Omega-3 per la salute cardiovascolare, i loro effetti benefici possono manifestarsi nelle problematiche che hanno una natura infiammatoria e di squilibrio immunitario, come nel caso delle autoimmunità (6).
Per approfondimenti sul tema DHA>> https://www.lipinutragen.it/omega-3-dha/
Bibliografia:
(1) Ermann J, et al. Autoimmune diseases: genes, bugs and failed regulation. Nature Immunology, volume 2, 759–761(2001).
(2) Lerner A, et al. Changes in intestinal tight junction permeability associated with industrial food additives explain the rising incidence of autoimmune disease. Autoimmun Rev. 2015 Jun;14(6):479-89.
(3) Okada H, et al. The ‘hygiene hypothesis’ for autoimmune and allergic diseases: an update. Clin Exp Immunol. 2010 Apr; 160(1):1-9.
(4) Strachan DP. Hay fever, hygiene, and household size. BMJ 1989; 299:1259–60.
(5) Zaccone P, et al. Parasitic worms and inflammatory diseases. Parasite Immunol. 2006 Oct; 28(10): 515–523.
(6) Haghikia A, et al. Dietary Fatty Acids Directly Impact Central Nervous System Autoimmunity via the Small Intestine. Immunity CellPress, Volume 43, Issue 4, P817-829, October 20, 2015
Articolo a cura di:
Francesco Bonucci – MSc, Biologo Nutrizionista
I consigli alimentari presenti nell’articolo non sono da intendersi sostitutivi di un piano alimentare personalizzato e sono da adattare ai casi specifici.
Foto: 123RF Archivio Fotografico: 108757381 ©Tatjana Baibakova / 123rf.com
- Il 9 Ottobre 2020