Orologio biologico ed alimentazione


Alimentazione circadiana
La storia evolutiva dell’uomo testimonia che siamo una specie animale diurna. Nella parte della giornata illuminata dalla luce del sole si sono infatti sempre svolte le principali attività di ricerca e consumo del cibo e coerentemente a ciò si è sviluppata la nostra fisiologia. Nella fase di riposo notturno invece, predominano le funzioni di investimento biologico, volte a riparare e rigenerare organi e tessuti come ad esempio quelle che avvengono nel sonno REM.
L’uomo si è scollegato dall’ambiente in cui vive in modo graduale, fino ad arrivare ai giorni nostri in cui, nella società occidentale questo legame è andato quasi completamente perduto, insieme al retaggio di conoscenze della cultura tradizionale. Questa perdita di collegamento con le tradizioni si è avuta anche nel modo in cui ci si alimenta: la qualità dei cibi (cosa), la loro quantità (quanto) e gli orari di consumo dei pasti (quando).
Crono-Nutrizione
Come descritto in un precedente articolo, esiste una finestra ottimale in cui alimentarsi ed è regolata da un orologio posto a livello del sistema nervoso centrale (central clock) sincronizzato con diversi orologi periferici (slave clock), presenti sia a livello cellulare con espressioni geniche che di organo con le varie funzioni. Alcuni clock periferici sono stati individuati a livello del fegato, del pancreas, dell’intestino, del tessuto adiposo e di quello muscolare.
I primi studi sul legame genetico tra ritmi circadiani e metabolismo riguardano la mutazione del gene ClockΔ19/Δ19 su modelli murini sottoposti a disregolazione del ritmo giorno-notte. Il risultato di questo studio mostrava come questa mutazione portava allo sviluppo nei modelli animali di aritmia, iperfagia, iperlipidemia con steatosi epatica, disglicidemia da disregolazione insulinica (1).
In questi anni sempre più evidenze scientifiche hanno mostrato che la disregolazione circadiana del ritmo sonno-veglia e del ciclo pasti-digiuno conducono a disfunzioni metaboliche e a un aumentato rischio di malattia, citando tra gli altri il Nurses’ Health Study (https://www.nurseshealthstudy.org/).
Il coordinamento tra il clock centrale e quelli negli organi periferici avviene attraverso segnali nervosi, endocrini, di temperatura corporea e comportamenti quali il ritmo sonno-veglia e gli orari dei pasti.
Appare così che anche il pancreas possiede un suo orologio biologico che influenza la sua secrezione di insulina che, in condizioni fisiologiche e senza stimolazione indotta da cibo, raggiunge un minimo nelle ore della notte (2). Nella finestra notturna infatti prevale la presenza di altri ormoni quali ad esempio la melatonina, il GH, il glucagone, ecc. e i processi immunitari e riparativi.
Come prevedere quanto l’insulina post-prandiale resti in circolo?
Indice insulinico dei cibi (FII)
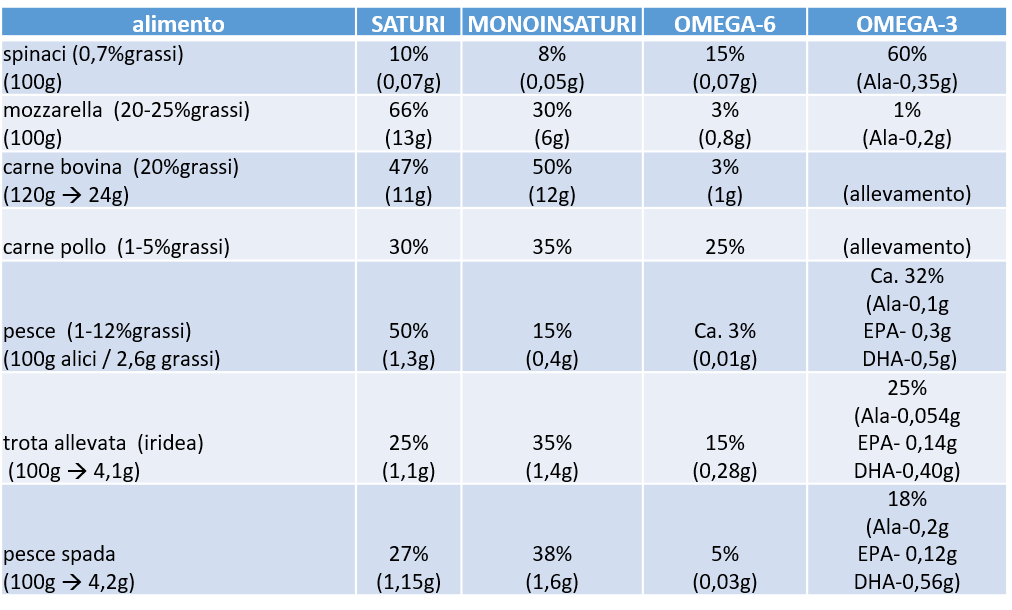
L’indice insulinico dei cibi (FII) è un recente parametro che indica l’incremento di secrezione di insulina post-prandiale rispetto ai singoli cibi (3). Le informazioni fornite da questo parametro sono molto promettenti e si integrano con quelle dell’indice e del carico glicemico perché questi ultimi non sono sempre correlano con la risposta insulinemica. Questo si verifica perché nella realtà non si mangiano i singoli macronutrienti ma si consumano pasti complessi in cui sono presenti carboidrati, proteine e grassi.
Effetto dei lipidi nel pasto
I lipidi ad esempio, presi singolarmente non stimolano particolarmente il rilascio di insulina, mentre aggiunti ai carboidrati aumentano fino al 60% la risposta insulinemica (4). Risulta infatti che l’aggiunta dei grassi ai pasti allunghi anche di molto la curva insulinemica.
Studi fatti in passato hanno determinato che il tempo di permanenza dell’insulina in circolo dopo un pasto misto dipende dal tipo di grassi ingeriti, in particolare dalla lunghezza della loro catena e dal numero di doppi legami presenti (5).
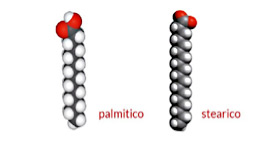
Per i non addetti ai lavori, i grassi sono formati da catene di atomi di carbonio, il cui numero di atomi è indicato dalla prima cifra, e la presenza o meno di doppi legami dal numero dopo i due punti.
Da queste premesse risulta che quelli che incidono maggiormente sulla curva insulinemica sono i grassi saturi a lunga catena, come ad esempio il palmitico (C 16:0) e lo stearico (C 18:0) (Figura1).
Il famoso acido palmitico dell’olio di palma è un C 16:0, ha 16 atomi di carbonio e 0 doppi legami. L’acido oleico dell’olio extravergine d’oliva un C 18:1, 18 atomi di carbonio e 1 doppio legame.
Seguire un’alimentazione circadiana
Per impostare un’alimentazione circadiana è importante prevedere la massima assunzione calorica nelle prime fasi della giornata; ad esempio i 2/3 delle calorie totali tra colazione, pranzo e spuntini vari e con la cena leggera, in termini di richiesta insulinica.
La sequenza dei pasti va inoltre modulata in base alle diverse attività svolte (tipo di lavoro, sport, ecc.) e in base agli orari obbligati della cena. Se non è possibile anticipare l’ora dell’ultimo pasto giornaliero, si dovrebbe fare in modo che il suo carico – in termini di calorie e di macronutrienti – sia inversamente proporzionale al suo orario.
Un basso effetto insulinotropico si ottiene con un pasto a prevalenza vegetale, con poche proteine (prevalentemente da fonti vegetali o da pesce) e grassi mono o polinsaturi. Eventuali carboidrati amidacei andranno scelti tra quelli a basso impatto glicemico anche per non stimolare la formazione endogena di grassi saturi.
Per tenere al minimo la risposta insulinemica del pasto serale, bisognerà ridurre o escludere le fonti di grassi saturi presenti nei cibi grassi (salumi, formaggi stagionati, mascarpone, ecc.) o nei condimenti aggiunti (burro).
Bibliografia:
(1) Marcheva B, et al. Disruption of the clock components CLOCK and BMAL1 leads to hypoinsulinaemia and diabetes. Nature. 2010; 466:627–631.
(2) Vieira E., et al. Clock genes, pancreatic function, and diabetes. Trends Mol. Med. 20, 685–693 (2014).
(3) Bao J., et al. Food insulin index: physiologic basis for predicting insulin demand evoked by composite meals. Am J Clin Nutr 2009;90:986–92.
(4) Validation of the food insulin index in lean, young, healthy individuals, and type 2 diabetes in the context of mixed meals: an acute randomized crossover trial.
(5) McGarry J., et al. The insulinotropic potency of fatty acids is influenced profoundly by their chain length and degree of saturation. J Clin Invest. 1997 Jul 15; 100(2): 398–403
Articolo a cura di:
Francesco Bonucci – MSc, Biologo Nutrizionista
I consigli alimentari presenti nell’articolo non sono da intendersi sostitutivi di un piano alimentare personalizzato e sono da adattare ai casi specifici.
Foto: 123RF Archivio Fotografico: 135057917 ©normaals /123rf.com
- Il 26 Marzo 2020